|
Rezumatul etapei I |
|
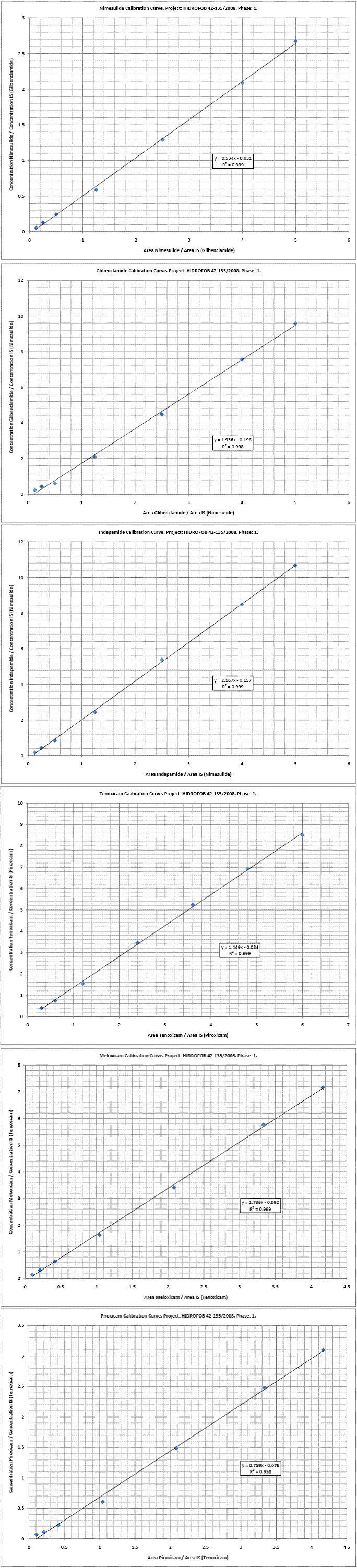
Testarea dizolvarii in vitro reprezinta un important instrument pentru caracterizarea calitații biofarmaceutice a formei de dozare în diferite stadii de elaborare a medicamentului. În cadrul primei etape a proiectului a fost realizata o analiza detaliata a stadiului actual al corelarii intre rezultatelor studiilor in-vivo, de investigare a biodisponibilitatii si bioechivalentei, cu parametrii furnizati de metodologie de investigare in-vitro a performanetelor biofarmaceutice pentru formele farmaceutice solide, asa cum sunt ele impuse de normele de reglementare in domeniu, in special cele ale Food and Drug Administration. A fost dezvoltata si validata metodologiei de analiza calitativa si cantitiva prin lichid cromatografie de inalta perfomanta a celor doua grupe farmaco-terapeutice de interes in cadrul proiectului, respectiv oxicami si sulfonamide. Metodologia de identificare si determinare cantitativa a compușilor de interes a vizat un timp redus de analiza, cu utilizarea in toate cazurile a unui standard intern pentru un control adecvat al procedurii. Au fost speculate astfel diferentele structurale, reusindu-se evaluarea simultana, prin implementarea acelorasi parametrii de operare in cadrul fiecarui grup: -oxicami: -analiza piroxicamului si meloxicamului, utilizand drept standard intern tenoxicamul; -analiza tenoxicamului, utilizand drept standard intern piroxicamul; -monitorizarea la trei lungimi de unda, corespunzatoare maximului de absorbanta in domeniul UV al fiecarui compus (322, 354 si 378 nm). -timp de analiza a unei probe 6 minute. -domeniul de concentratii pentru care s-a realizat validarea metodologiei de analiza HPLC: 25 - 1000 ppb (ng/mL) pentru meloxicam si piroxicam; 30 1200 ppb (ng/mL) pentru tenoxicam. -sulfonamide: -analiza indapamidului si glibenclamidului, utilizand drept standard intern nimesulidul; -analiza nimesulidului, utilizand drept standard intern glibenclamidul; -monitorizarea la o singura lungime de unda, (242 nm). -timp de analiza a unei probe 15, respectiv 5 minute. -domeniul de concentratii pentru care s-a realizat validarea metodologiei de analiza HPLC: 25 - 1000 ppb (ng/mL). |